Фосфор (P) — элемент VA группы и третьего периода. У фосфора 5 внешних электронов, в соединениях он проявляет различные степени окисления: -3, +3, +5. Фосфор может иметь и другие С.О., но в школе их не изучают 👀
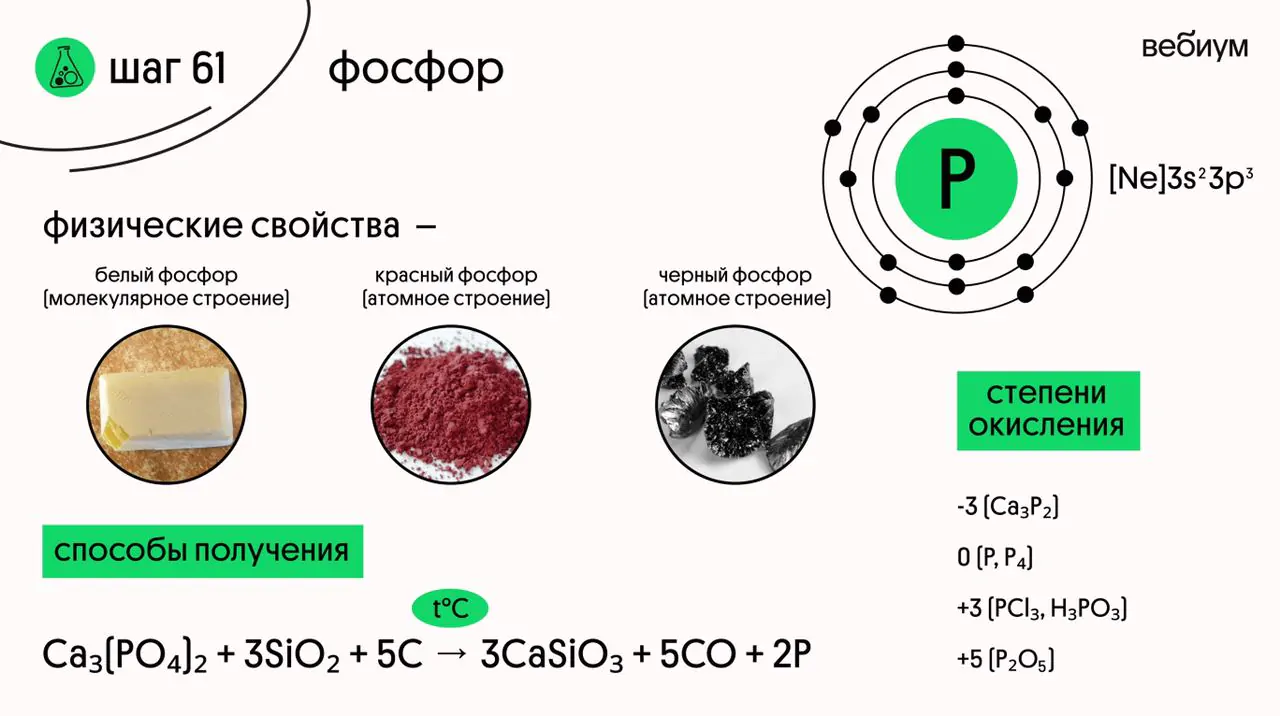
ℹ️ Простое вещество фосфор может существовать в нескольких аллотропных модификациях, по количеству которых фосфор вполне может состязаться с углеродом. Наиболее известными являются белый, красный и черный фосфор.
БЕЛЫЙ ФОСФОР существует в виде молекул P₄. Это белое воскообразное и очень токсичное вещество
БЕЛЫЙ ФОСФОР является люминофором, он самовозгорается при 25 °C
Из-за своего строения белый фосфор очень реакционноспособен, а ещё он очень ядовит. Намазать собаку белым фосфором, как в «Собаке Баскервилей» , конечно, можно, но проживет она после этого недолго. Однако к автору претензий нет, ошиблись переводчики!
При нагревании без доступа воздуха белый фосфор превращается в красный 🔴
КРАСНЫЙ ФОСФОР представляет собой неорганический полимер, в котором атомы фосфора связаны друг с другом. Это более стабильная модификация, но и менее реакционноспособная.
Красный фосфор окисляется сильными окислителями
При нагревании под высоким давлением красный фосфор превращается в чёрный ⚫
ЧЕРНЫЙ ФОСФОР по внешнему виду похож на графит, по строению это также неорганический полимер. Это наиболее термодинамически стабильная модификация. Черный фосфор химически инертен ❗
Фосфор получают из фосфата кальция при спекании его с песком и углем без доступа воздуха:
Ca₃(PO₄)₂ + 3SiO₂ + 5C → 3CaSiO₃ + 5CO + 2P (t°C)
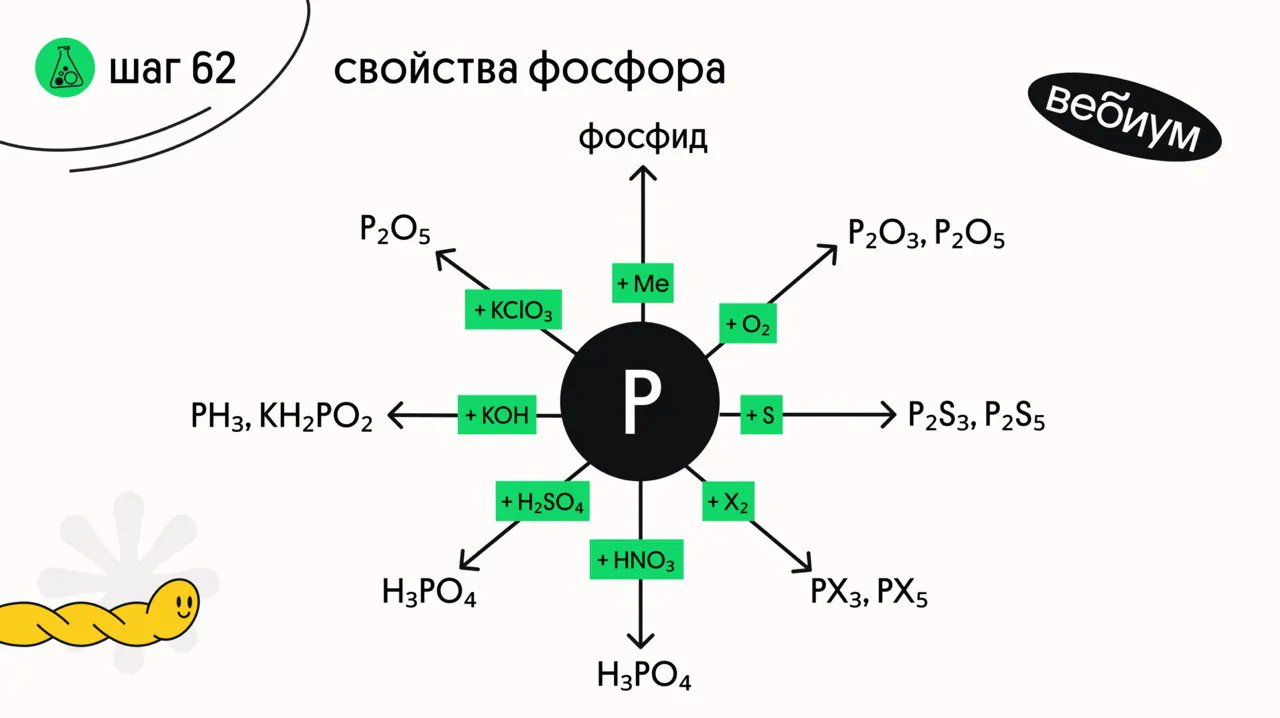
наибольшей химической активностью обладает белый фосфор.
Его формула P₄, однако на ЕГЭ можно писать просто P
1️⃣ + металлы
3Ca + 2P → Ca₃P₂ (t°C)
Фосфиды щелочных и щелочноземельных металлов легко гидролизуются с образованием фосфина:
Ca₃P₂ + 6H₂O → 3Ca(OH)₂ + 2PH₃
Ca₃P₂ + 6HCl → 3CaCl₂ + 2PH₃
2️⃣ + неметаллы
2P + 3S → P₂S₃ (t°C)
2P + 5S (изб) → P₂S₅ (t°C)
4P + 3O₂ → 2P₂O₃ (t°C)
4P + 5O₂ (изб) → 2P₂O₅ (t°C)
2P + 5F₂ → 2PF₅
2P + 3Cl₂ → 2PCl₃ (t°C)
2P + 5Cl₂ (изб) → 2PCl₅ (t°C)
2P + 3Br₂ → 2PBr₃ (t°C)
2P + 5Br₂ (изб) → 2PBr₅ (t°C)
2P + 3I₂ → 2PI₃ (t°C)
Фосфор не реагирует с водородом ❌
3️⃣ + щёлочи
4P + 3KOH + 3H₂O → PH₃ + 3KH₂PO₂
4️⃣ + конц. кислоты-окислители
P + 5HNO₃ → H₃PO₄ + 5NO₂ + H₂O
2P + 5H₂SO₄ → 2H₃PO₄ + 5SO₂ + 2H₂O
5️⃣ + хлораты
6P + 5KClO₃ → 3P₂O₅ + 5KCl
Это реакция инициируется механически (можно просто стукнуть по смеси реагентов)
Эту реакцию вы проводите каждый раз, когда зажигаете обычную спичку!
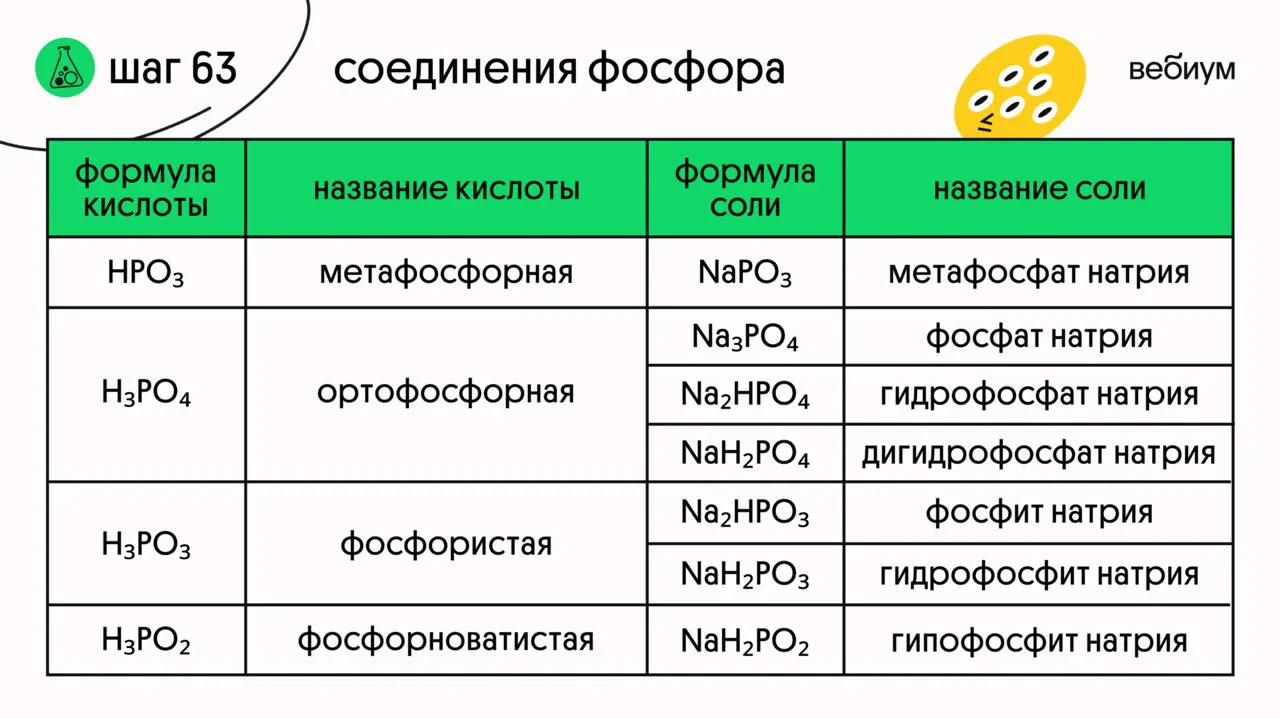
Соединений у фосфора не так уж и мало, но на наше счастье свойства учить придется только у некоторых из них 🙃
🔸ОКСИД ФОСФОРА(III)
P₂O₃ — белое кристаллическое вещество, легко испаряется, имеет неприятный запах. Это кислотный оксид. При растворении в воде образует фосфористую кислоту:
P₂O₃ + 3H₂O → 2H₃PO₃
Оксид фосфора(III) получают медленным окисления фосфора при недостатке кислорода:
4P + 3O₂ → 2P₂O₃ (t°C)
🔸ОКСИД ФОСФОРА(V)
P₂O₅ — белое кристаллическое вещество. Типичный кислотный оксид, очень гигроскопичный. При растворении в воде образует фосфорную кислоту:
P₂O₅ + 3H₂O → 2H₃PO₄
Оксид фосфора(V) получает окислением фосфора в избытке кислорода:
4P + 5O₂ (изб) → 2P₂O₅ (t°C)
Как кислотный оксид реагирует с основными оксидами и щелочами:
P₂O₅ + 3СaO → Ca₃(PO₄)₂
P₂O₅ + 6NaOH → 2Na₃PO₄ + 3H₂O (также возможно образование кислых солей)
P₂O₅ — водоотнимающий агент. Его используют для осушения веществ в эксикаторе и для получения ангидридов кислот
🔸ФОСФОРНАЯ КИСЛОТА
H₃PO₄ — бесцветное кристаллическое вещество, хорошо растворимое в воде. Кислота средней силы:
2H₃PO₄ + 3Сa → Ca₃(PO₄)₂ + 3H₂
2H₃PO₄ + 3CaO → Ca₃(PO₄)₂ + 3H₂O
Фосфорную кислоту можно получить растворением соответствующего оксида в воде:
P₂O₅ + 3H₂O → 2H₃PO₄
Авторизуйтесь, чтобы оставить комментарий.