Его иногда называют амфотерным металлом, но давайте договоримся, что никаких амфотерных металлов не существует❗️Есть амфотерные оксиды и гидроксиды, про металлы так говорить неправильно.
🔻Алюминий (Al) — элемент IIIA группы, металл. На внешнем уровне у него 3 электрона, в соединениях постоянная степень окисления +3.
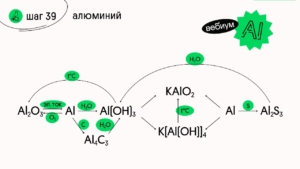
Получают алюминий электролизом раствора оксида Al₂O₃ в расплаве криолита (Na₃[AlF]₆ )
2Al₂O₃ = 4Al₂O₃ + 3O₂ (эл. ток)
Активность металла понижена из-за плотной защитной плёнки на поверхности — Al₂O₃. Но если эту плёнку убрать, то алюминий окажется весьма реакционноспособным металлом!
1️⃣ + неметаллы
4Al + 3C = Al₄C₃ (t°C)
2Al + N₂= 2AlN (t°C)
4Al + 3O₂= 2Al₂O₃
2Al + 3Cl₂= 2AlCl₃
Также реагирует с фосфором, серой, другими галогенами.
С водородом алюминий не реагирует ❌
2️⃣ + вода
Реакция с водой протекает интенсивно и без нагревания, главное снять оксидную плёнку. Если плёнку не удалить, реакция не пойдет!
2Al + 6H₂O = 2Al(OH)₃ + 3Н₂
3️⃣ + кислоты
2Al + 6НCl = 2AlCl₃ +3Н₂
4️⃣ + кислоты-окислители
С концентрированными кислотами-окислителями алюминий реагирует только при нагревании! На холоду происходит пассивация.
2Al +6H₂SO₄ (конц.) = Al₂(SO₄)₃ + 3SO₂ + 6Н₂O (t°C)
Al + 6НNO₃ (конц.) = Al(NO₃)₃ +3NO₂ + 3Н₂O (t°C)
8Al + 30НNO₃ (оч.разб)= 8Al(NO₃)₃ + 3NH₄NO₃ + 9Н₂O
5️⃣ + соли менее активных металлов
2Al + 3CuCl₂ = 2AlCl₃ + 3Cu
6️⃣ + щелочь
Своим прозвищем «амфотерный» алюминий как раз обязан этой реакции с щелочами
В растворе щёлочи:
2Al + 2KOH+ 6H₂O= 2K[Al(OH)₄]+ 3H₂
В расплаве:
2Al + 2KOH + 2H₂O = 2KAlO₂ + 3H₂ (t°C)
(или 2Al + 6KOH = 2KAlO₂ + 2K₂O + 3H₂)
7️⃣ + оксиды металлов
Это один из способов получения некоторых металлов. Называется он алюмотермия
8Al+ 3Fe₃O₄ = 4Al₂O₃ + 9Fe (t°C)
Авторизуйтесь, чтобы оставить комментарий.