✍️ При нагревании образца карбоната кальция часть вещества разложилась. При этом выделилось 4,48 л (н.у.) углекислого газа. Масса твёрдого остатка составила 41,2 г. Этот остаток добавили к 465,5 г раствора соляной кислоты, взятой в избытке. Определите массовую долю соли в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
💯 Решение (с комментариями):
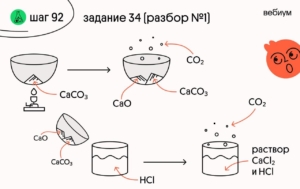
1️⃣ Запишем уравнения реакций:
(1) CaCO₃ → CaO + CO₂
(2) CaO + 2HCl → CaCl₂ + H₂O
(3) CaCO₃ + 2HCl → CaCl₂ + CO₂ + H₂O
Обратите внимание, карбонат кальция разложился не полностью, поэтому он тоже будет взаимодействовать с соляной кислотой.
2️⃣ Рассчитаем количество углекислого газа, выделившегося в реакции (1):
n(CO₂) = Vн.у.(CO₂) / Vm = 4,48 л / 22,4 л/моль = 0,2 моль
Согласно уравнению реакции (1) n(CO₂) = n(CaO) = 0,2 моль
3️⃣ Твёрдый остаток (после разложения) — это смесь образовавшегося оксида кальция (в количестве 0,2 моль) и неразложившегося карбоната кальция. Рассчитаем массу оксида кальция в этом остатке:
m(CaO) = n(CaO)⋅M(CaO) = 0,2 моль⋅56 г/моль = 11,2 г
Если масса остатка 41,2 г, а масса оксида кальция всего 11,2 г, значит, остальные 41,2 г — 11,2 г = 30 г приходятся на карбонат кальция!
m(CaCO₃ ост.) = 30 г
n(CaCO₃ ост.) = m(CaCO₃ ост.) / M(CaCO₃) = 30 г / 100 г/моль = 0,3 моль
4️⃣ Нас спрашивают о массовой доли соли (CaCl₂) в полученном после растворения остатка растворе. Для начала найдём её количество.
По уравнению (2) n(CaCl₂) = n(CaO) = 0,2 моль.
По уравнению (3) n(CaCl₂) = n(CaCO₃) = 0,3 моль.
Общее количество соли в растворе n(CaCl₂) = 0,2 моль + 0,3 моль = 0,5 моль
Рассчитаем массу соли:
m(CaCl₂) = n(CaCl₂)⋅M(CaCl₂) = 0,5 моль ⋅ 111 г/моль = 55,5 г
5️⃣ Самое сложное — рассчитать массу раствора 😫
Тут нам пригодится закон сохранения массы вещества, согласно которому суммарная масса реагентов равна суммарной массе продуктов. Главное помнить, что выделившийся в реакции (3) CO₂ в состав раствора не входит, он улетает из среды реакции, поэтому его массу придётся вычитать!
n(CO₂) = n(CaCO₃ ост.) = 0,3 моль
m(CO₂) = n(CO₂)⋅M(CO₂) = 0,3 моль ⋅ 44 г/моль = 13,2 г
6️⃣ Масса конечного раствора:
m(конечн. р-ра) = m(р-ра HCl) + m(тв. остатка) — m(CO₂) = 465,5 г + 41,2 г — 13,2 г = 493,5 г
7️⃣ Массовая доля соли:
w(CaCl₂) = m(CaCl₂) ⋅ 100% / m(конечн. р-ра) = 55,5 г ⋅ 100% / 493,5 г = 11,2%
❗️В этой задаче два «коварных» момента:
• Исходное вещество разлагается не полностью, а значит входит в состав твёрдого остатка и может участвовать в дальнейших реакциях.
• При вычислении массы конечного раствора нужно учесть, что газы и осадки в состав растворе не входят, их массу (в нашем случае только CO₂) следует вычитать.
Авторизуйтесь, чтобы оставить комментарий.