Углерод (С) — элемент IVA группы. У углерода 4 валентных электрона. В возбужденном состоянии у углерода 4 неспаренных электрона на четырех орбиталях.
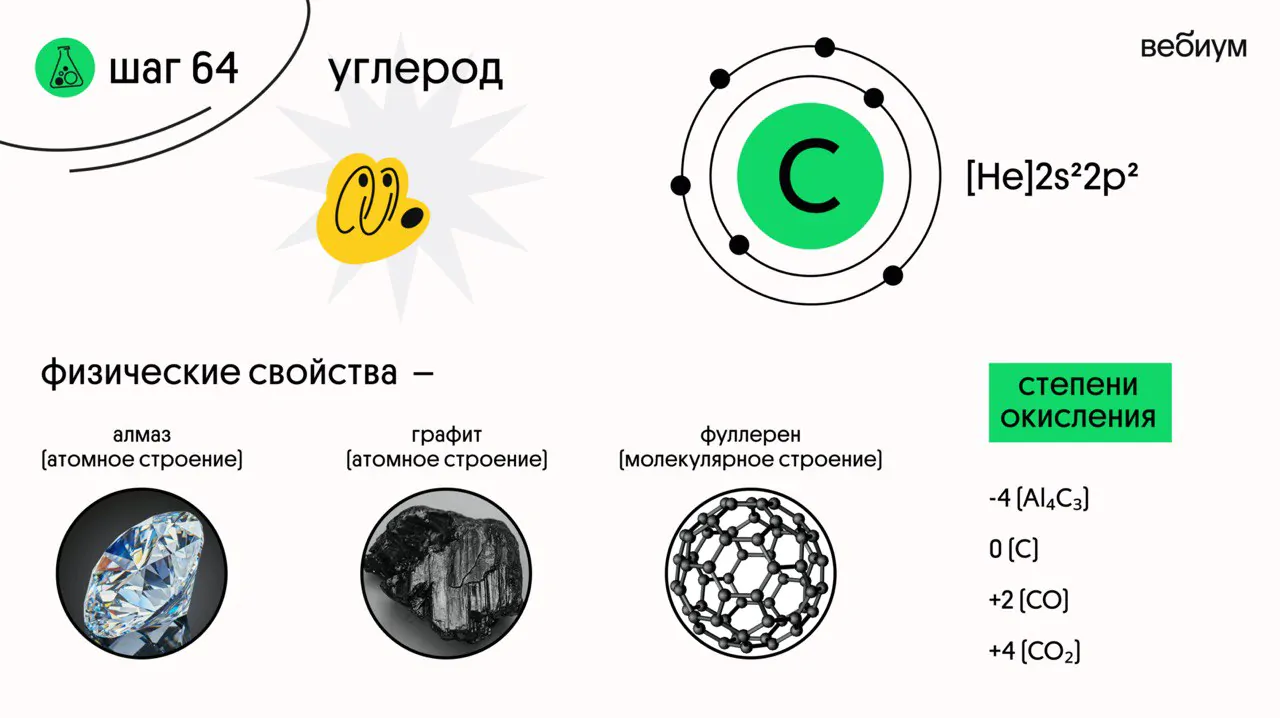
С учетом органических соединений, углерод в соединениях проявляет степени окисления от -4 до +4. В неорганических соединениях углерод проявляет степень окисления -4, +2 и +4.
Углерод подарил нам органические соединения. Поэтому органическую химию иногда называют химией углерода!
Количество органических соединений невозможно определить, именно органические вещества — основа всего живого.
Углерод простое вещество существует в различных аллотропных модификациях:
Графит представляет собой чёрное вещество атомного строения.
Каждый атом углерода ковалентно связан с двумя другими. Образующиеся слои связаны друг с другом слабыми межмолекулярными связями. Эта слабая связь легко рвется, поэтому графит используют для изготовления карандашей (при письме часть слоёв остается на бумаге).
Если оставить только один слой графита, то образуется другая модификация — графен.
За исследование графена не так давно (2010 г) была вручена Нобелевская премия 🏆
Это самая прочная (не путать со стабильностью) модификация! Представляет собой прозрачные кристаллы 💎 Алмаз имеет атомное строение.
Это чёрное кристаллическое вещество молекулярного строения. В отличии от алмаза и графита фуллерен растворяется в органических растворителях.
В школе обычно изучают фуллерен С₆₀, но существуют и другие, только тсс 🤫
Получать углерод не нужно, он в больших количествах находится в природе, поэтому углерод добывают!
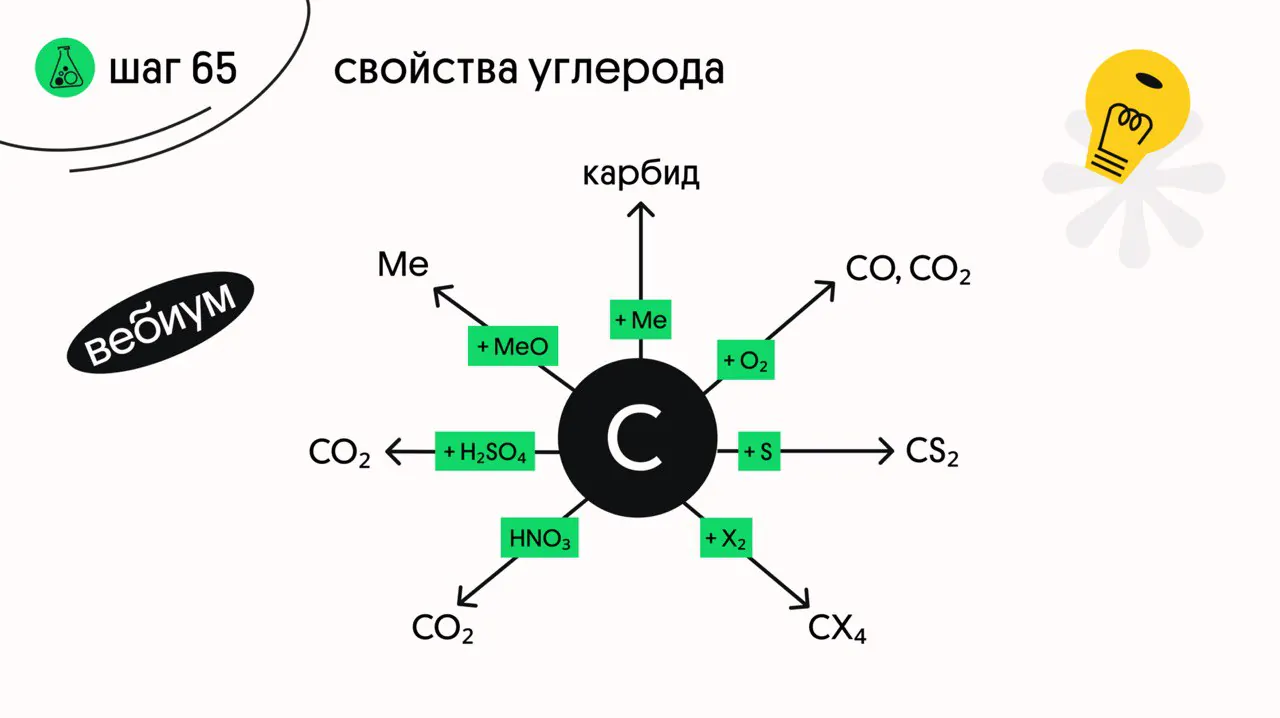
Различные модификации углерода обладают разной активностью, но обычно различия между ними в школьном курсе не делают..
1️⃣ + металлы
При нагревании реагирует с активными металлами и некоторыми металами средней активности. Обратите внимание, что карбиды различных металлов отличаются строением и свойствами
2C + Ca → CaC₂ (t°C)
CaC₂ + 2H₂O → Ca(OH)₂ + C₂H₂
3C + 4Al → Al₄C₃ (t°C)
Al₄C₃ + 12H₂O → 4Al(OH)₃ + 3CH₄ (t°C)
2️⃣ + неметаллы
Углерод взаимодействует с неметаллами (водород, кремний, сера, кислород, фтор):
С + 2H₂ → CH₄ (t°C)
C + Si → SiC (t°C)
C + 2S → CS₂ (t°C)
2C + O₂ (нед.) → 2CO (t°C)
C + O₂ (изб.) → CO₂ (t°C)
С + 2F₂ → CF₄ (t°C)
Углерод не реагирует с азотом, иодом ❌
3️⃣ + конц. кислоты-окислители
С + 2H₂SO₄ → CO₂ + 2SO₂ + 2H₂O
C + 4HNO₃ → CO₂ + 4NO₂ + 2H₂O
4️⃣ + оксиды металлов
3С + Fe₂O₃ → 3CO + 2Fe (t°C)
При взаимодействии углерода и оксидов активных металлов образуются карбиды:
3С + CaO → CaC₂ + CO (t°C)
5️⃣ + оксиды неметаллов
С + СO₂ → 2CO (t°C)
2C + SiO₂ → Si + 2CO (t°C)
3C + SiO₂ → SiC + 2CO (t°C)
C + H₂O → CO + H₂ (t°C) — паровая конверсия угля
ОКСИД УГЛЕРОДА(II)
CO — газ без цвета и запаха, легче воздуха. Угарный газ очень токсичен ⚠️
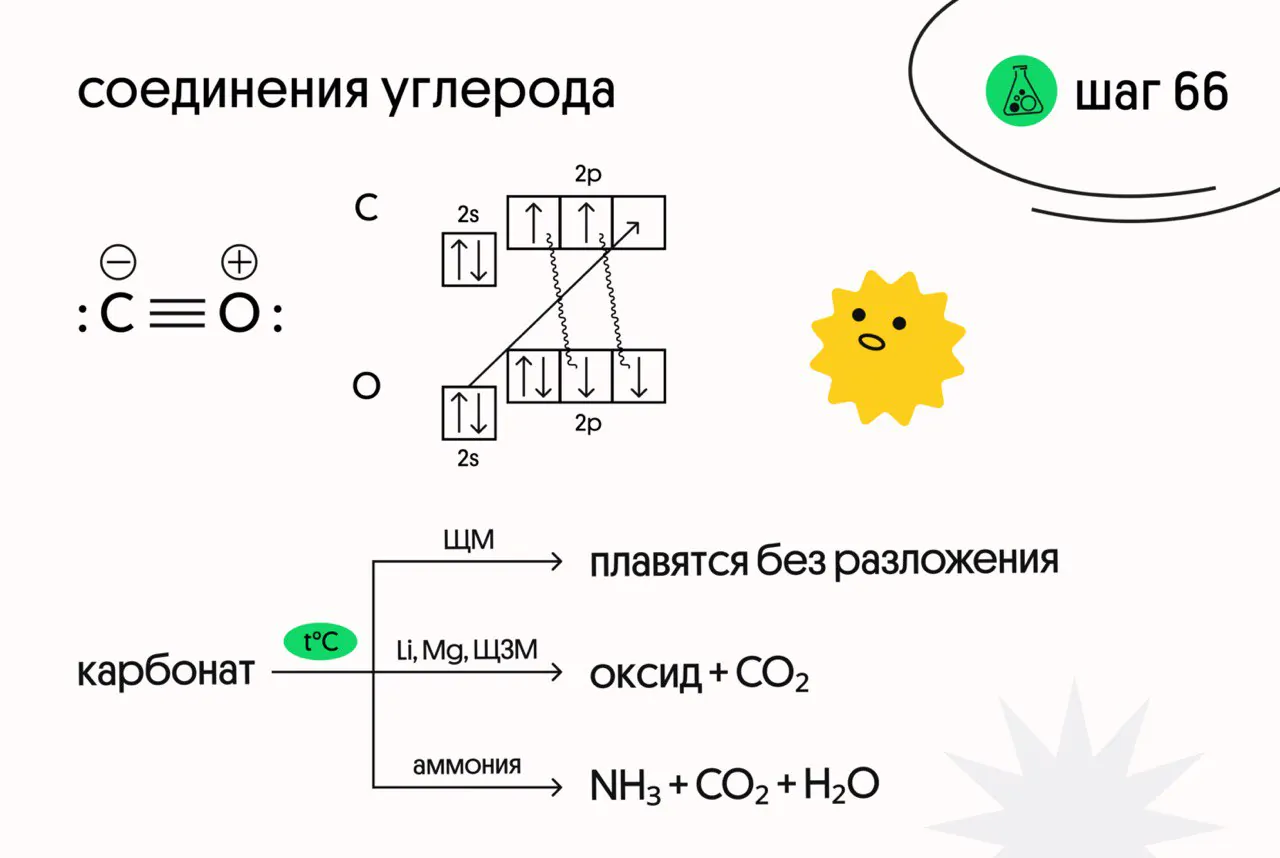
Молекула CO имеет тройную связь (то есть валентность углерода и кислорода равна III)
Этот оксид получают при горении угля в недостатке кислорода:
2C + O₂ (нед.) → 2СO (t°C)
CO — несолеобразующий оксид, хотя может реагировать с твердыми щелочами с образованием формиатов:
CO + KOH (тв.) → HCOOK (t°C)
Оксид углерода(II) используют для восстановления металлов из оксидов:
СuO + CO → Cu + CO₂ (t°C)
Fe₃O₄ + СО → 3FeO + СО₂ (t°C)
ОКСИД УГЛЕРОДА(IV)
CO₂ — газ без цвета и запаха.
Образуется в процессе дыхания 👃
В лаборатории углекислый газ можно получить действием сильных кислот на карбонаты:
CaCO₃ + 2HCl → CaCl₂ + CO₂ + H₂O
А ещё CO2 образуется при горении органических веществ и угля:
C + O₂ (изб.) → СO₂ (t°C)
2СH₃CHO + 5O₂ → 4CO₂ + 4H₂O (t°C)
4СH₃NH₂ + 9O₂ → 4CO₂ + 2N₂ + 10H₂O (t°C)
CO₂ — кислотный оксид, ему соответствует слабая летучая угольная кислота H₂CO₃
Авторизуйтесь, чтобы оставить комментарий.