ℹ️ Соединения хрома(II)
CrO — основный оксид
Cr(OH)₂ — основный гидроксид
CrO + 2HCl → CrCl₂ + H₂O
Cr(OH)₂ + 2HCl → CrCl₂ + H₂O
📌 Соединения хрома(II) — сильные восстановители, уже кислородом воздуха окисляются до соединений хрома(III)
4CrO + O₂ → 2Cr₂O₃
4Сr(OH)₂ + O₂ + 2H₂O → 4Cr(OH)₃
CrCl₂ + 4HNO₃ (конц.) → Сr(NO₃)₃ + NO₂ + 2HCl + H₂O
ℹ️ СОЕДИНЕНИЯ ХРОМА(III)
Cr₂O₃ — амфотерный оксид
Cr(OH)₃ — амфотерный гидроксид
Cr₂O₃ + 6HCl → 2CrCl₃ + 3H₂O
Cr₂O₃ + Ba(OH)₂ → Ba(CrO₂)₂ + H₂O (t°C)
Cr₂O₃ + K₂CO₃ → 2KCrO₂ + H₂O (t°C)
Хромиты легко реагируют с кислотами:
KCrO₂ + HCl (недостаток) + H₂O → Cr(OH)₃ + NaCl
KCrO₂ + 4HCl (избыток) → CrCl₃ + KCl + 2H₂O
Соединения хрома(III) при сплавлении с щелочами в присутствии сильных окислителей окисляются до хроматов.
Cr₂O₃ + 3Br₂ + 10NaOH → 2Na₂CrO₄ + 6NaBr + 5H₂O
2CrCl₃ + 3H₂O₂ + 10NaOH → Na₂CrO₄ + 6NaCl + 8H₂O
ℹ️ СОЕДИНЕНИЯ ХРОМА(VI)
СrO₃ — кислотный оксид
H₂CrO₄ — хромовая кислота
H₂Cr₂O₇ — дихромовая кислота
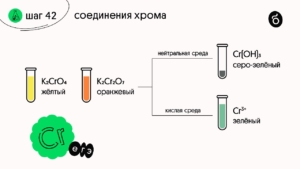
Отдельно стоит упомянуть соли кислот хрома. Хроматы — жёлтые, дихроматы — оранжевые. Они могут переходить друг в друга без изменения степени окисления:
K₂Cr₂O₇ + 2KOH → 2K₂CrO₄ + H₂O
2K₂CrO₄ + H₂SO₄ → K₂Cr₂O₇ + K₂SO₄ + H₂O
Авторизуйтесь, чтобы оставить комментарий.