ℹ️ Все галогенводороды при обычных условиях газообразные. Если их растворить в воде, то получится соответствующая кислота
Полярность в ряду HF — HCl — HBr — HI падает, прочность связи падает, сила кислот увеличивается!
Запомните, что плавиковая кислота (HF) — слабая!
Однако у нее есть одна интересная особенность — она может растворять оксид кремния SiO₂, другие кислоты не справятся:
SiO₂ + 4HF → SiF₄ + 2H₂O
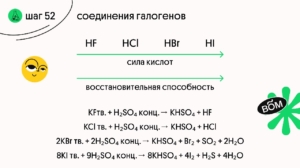
Получают HF и HCl по обменным реакциям твердых галогенидов и концентрированной серной кислоты:
KF + H₂SO₄ → HF + KHSO₄
KCl + H₂SO₄ → HCl + KHSO₄
Обрати внимание, что с бромидами и иодидами протекает ОВР с образованием галогенов ❗️
HBr и HCl получают гидролизом галогенидов фосфора:
PBr₅ + 4H₂O → H₃PO₄ + 5HBr
Все галогены, кроме фтора, образуют кислородсодержащие кислоты вида HXOn. Для нас наибольший интерес представляют оксокислоты хлора. Их названия, строение и свойства, а также свойства и названия их солей помогут тебе не потерять драгоценные баллы на ЕГЭ 💯
HClO — хлорноватистая кислота, соли — гипохлориты
HClO₂ — хлористая кислота, соли — хлориты
HClO₃ — хлорноватая кислота, соли — хлораты
HClO₄ — хлорная кислота, соли — перхлораты
В ряду HClO — HClO₂ — HClO₃ — HClO₄ сила кислот увеличивается, а окислительная способность уменьшается ❗️
Авторизуйтесь, чтобы оставить комментарий.