Сера (S) — элемент VIA группы, соседка кислорода. У серы, как и у кислорода, 6 валентных электронов.
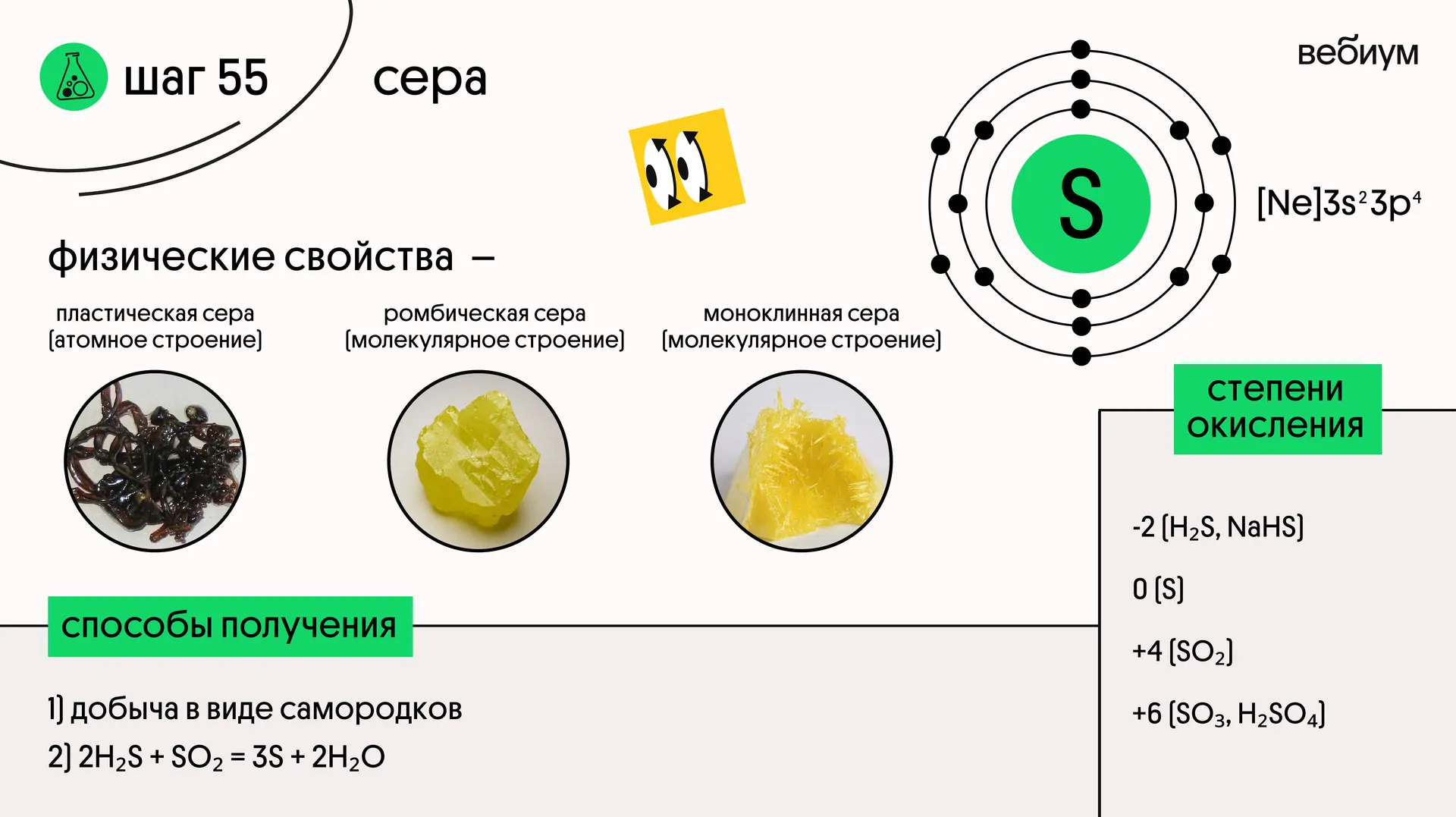
В соединениях сера проявляет степень окисления -2, +4, +6.
Простое вещество сера существует в трех аллотропных модификациях 👇
Ромбическая и моноклинная состоят из циклических молекул S₈ (то есть имеют молекулярное строение), но упакованы эти «серы» по-разному. Кристаллы моноклинной и ромбической серы отличаются формой, отсюда и названия.
Пластическая сера — аморфное и нестабильное вещество.
Наиболее стабильная модификация — ромбическая.
Серу довольно легко перевести в пластическое состояние — для этого необходимо расплавить порошок и резко охладить.
📽️ Мы нашли видео специально для тебя: https://vk.cc/aCJMdE
Сера встречается в природе в самородном виде.
Также её получают из продуктов, сопутствующих нефти и природному газ
2H₂S + SO₂ → 3S + 2H₂O
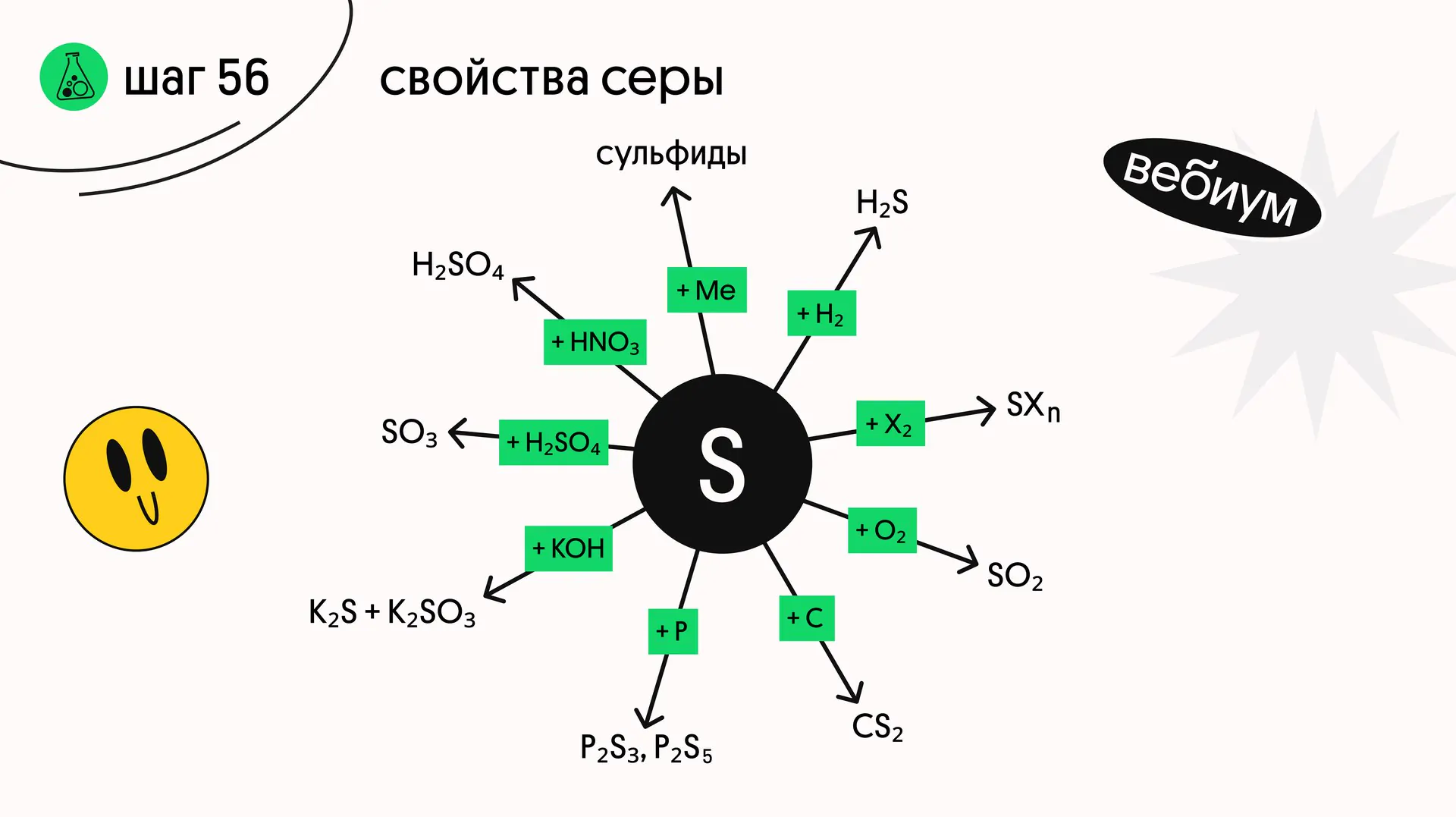
Сера — реакционноспособный неметалл, он реагирует с большим количеством соединений.
1️⃣ + металлы
Cu + S → CuS (t°C)
Hg + S → HgS (со ртутью реакция протекает без нагревания!)
2️⃣ + неметаллы
S + 3F₂ → SF₆
S + O₂ → SO₂ (t°C)
2S + C → CS₂ (t°C)
H₂ + S ⇄ H₂S (t°C)
Сера НЕ реагирует с азотом и иодом❌
3️⃣ + щёлочи
3S + 6KOH → 2K₂S + K₂SO₃ + 3H₂O (t°C)
4️⃣ + кислоты-окислители
S + 2H₂SO₄ (конц.) → 3SO₂ + 2H₂O (t°C)
S + 6HNO₃ (конц.) → H₂SO₄ + 6NO₂ + 2H₂O (t°C)
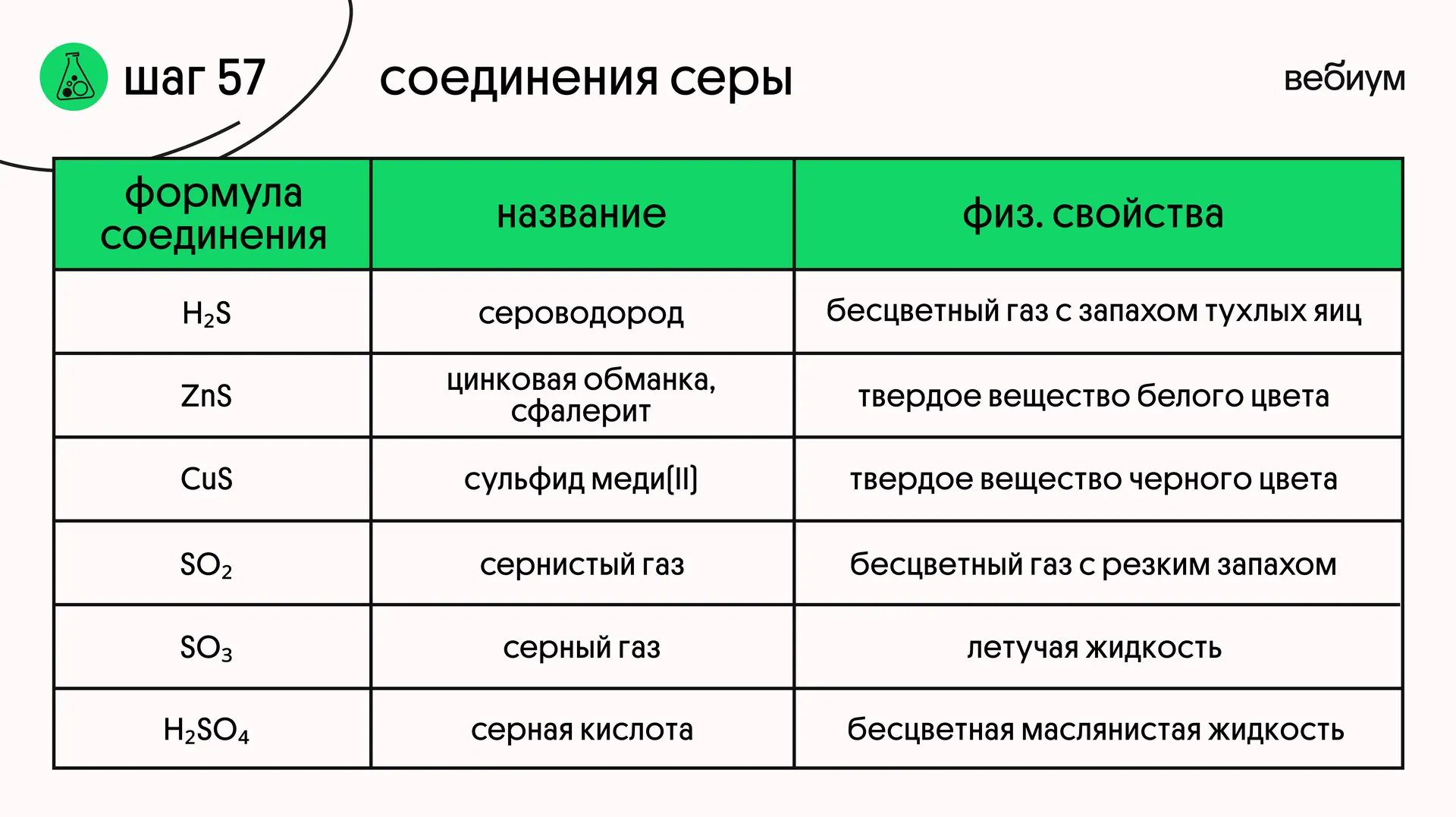
СЕРОВОДОРОД 🤭
Даже люди, далекие от химии, помнят, что сероводород (H₂S) обладает резким и неприятным запахом тухлых яиц
Кроме того этот газ токсичен❗
Обычно в лаборатории сероводород получают действием разбавленных кислот на сульфиды:
FeS + 2HCl → H₂S + FeCl₂
ℹ️ Cероводород — типичный восстановитель. Он легко сгорает в кислороде и окисляется галогенами:
H₂S + O₂ → SO₂ + H₂O (t°C)
H₂S + Br₂ → S + 2HBr (с I₂ аналогично)
Раствор сероводорода в воде — слабая сероводородная кислота, образующая средние и кислые соли.
Также как и сероводород — типичный восстановитель:
H₂S + 4Сl₂ + 4H₂O → H₂SO₄ + 8HCl
2FeCl₃ + H₂S → 2FeCl₂ + S + 2HCl
ℹ️ ОКСИД СЕРЫ(IV)
SO₂ — сернистый ангидрид, сернистый газ. Это бесцветный газ с резким запахом, термически устойчив, хорошо растворим в воде
Получают его обжигом серы или сульфидов:
S + O₂ → SO₂ (t°C)
4FeS₂ + 11O₂ → 2Fe₂O₃ + 8SO₂ (t°C)
Также SO₂ образуется при обработке солей сернистой кислоты минеральными
кислотами:
Na₂SO₃ + 2HCl → 2NaCl + SO₂ + H₂O
ℹ️ SO₂ — типичный кислотный оксид. При его растворении в воде образуется сернистая кислота H₂SO₃. Сернистая кислота существует только в растворе
Ba(OH)₂ + SO₂ → BaSO₃ + H₂O
Ba(OH)₂ + 2SO₂ → Ba(HSO₃)₂
SO₂ легко окисляется. Реакции с окрашенными окислителями являются качественными на SO₂
SO₂ + Br₂ + 2H₂O → H₂SO₄ + 2HBr
5SO₂ + 2KMnO₄ + 2H₂O → K₂SO₄ + 2MnSO₄ + 2H₂SO₄
ℹ️ ОКСИД СЕРЫ(VI)
SO₃ — серный ангидрид. Это бесцветная летучая жидкость; на воздухе «дымит», сильно поглощает влагу
SO₃ хорошо растворяется в 100%-ной серной кислоте, такой раствор называется олеумом
Получают SO₃ окислением SO2 в присутствии катализатора
2SO₂ + O₂ ⇄ 2SO₃ (V₂O₅, t°C)
Серный ангидрид — кислотный оксид. Ему соответствует сильная кислота — H₂SO₄
2NaOH + SO₃ → Na₂SO₄ + H₂O
NaOH + SO₃ → NaHSO₄
Авторизуйтесь, чтобы оставить комментарий.