Кислород (O) — элемент VIA группы. На внешнем уровне у него 6 электронов, однако ни валентность VI, ни степень окисления +6 кислород не проявляет — это следует запомнить!
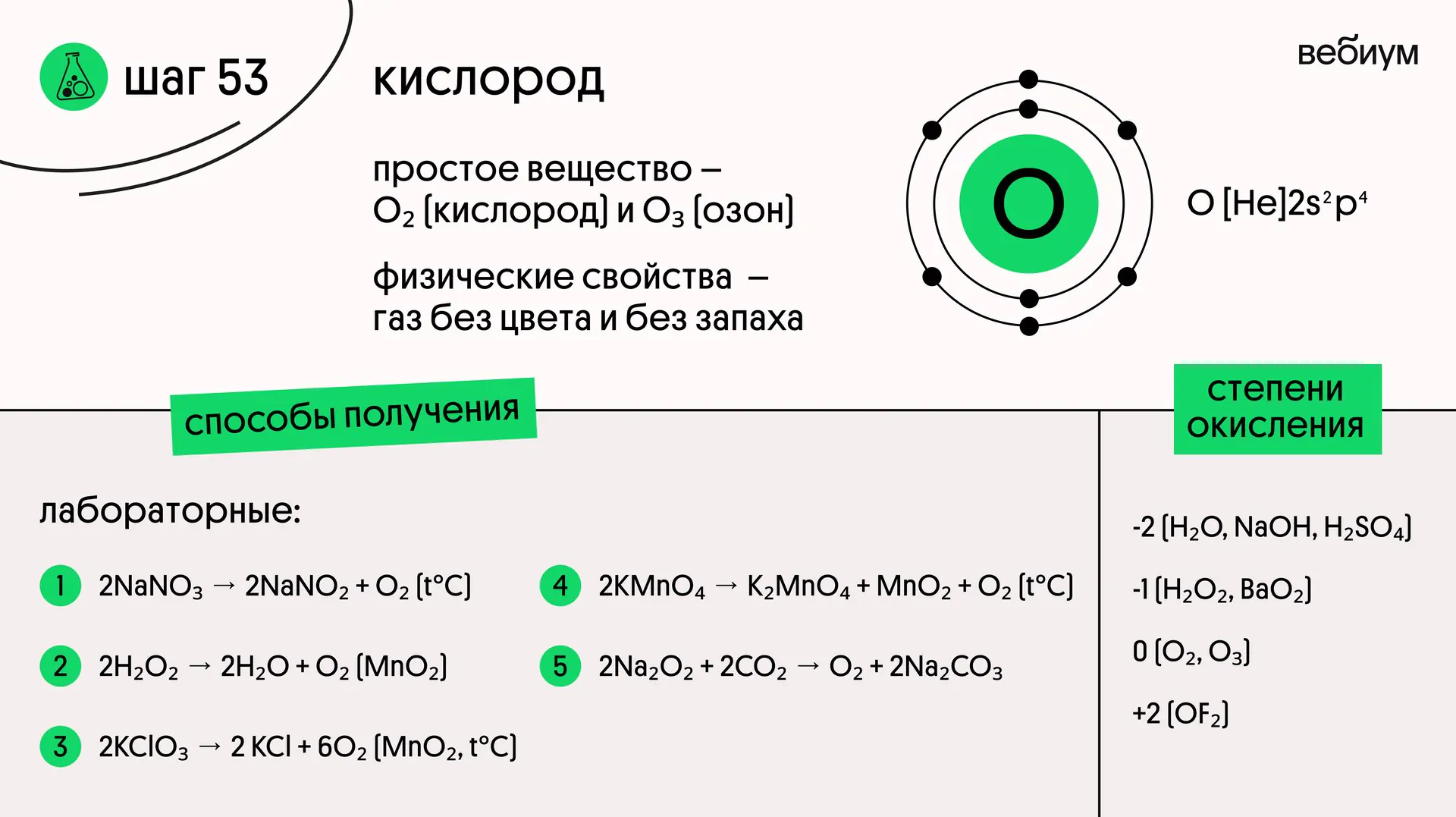
Максимальная валентность кислорода — IV;
максимальная степень окисления — +2.
Характерные степени окисления кислорода в соединениях -1 (в пероксидах) и -2 (в большинстве сложных соединениях).
🔻 В свободном состоянии кислород существует в двух аллотропных модификациях — озон (O₃) и кислород (O₂).
Озон существует в верхних слоях атмосферы и образует «озоновый слой» , который защищает нас от УФ излучения.
Это газ голубого цвета с резким запахом
Озон — сильнейший окислитель!
Кислород — газ без цвета и запаха, один из компонентов воздуха (21% по объему).
🔻 В промышленности кислород получают из воздуха, а в лаборатории термическим или каталитическим разложением различных соединений:
2NaNO₃ → 2NaNO₂ + O₂ (t°C)
2H₂O₂ → 2H₂O + O₂ (MnO₂)
2KClO₃ → 2 KCl + 6O₂ (MnO₂, t°C)
2KMnO₄ → K₂MnO₄ + MnO₂ + O₂ (t°C)
Также кислород можно получить электролизом воды:
2H₂O → 2H₂ + O₂ (эл. ток)
И по реакции «искусственного фотосинтеза» , её используют для регенерации кислорода в помещениях без доступа воздуха — подлодках и космических станциях
2Na₂O₂ + 2CO₂ → O₂ + 2Na₂CO₃
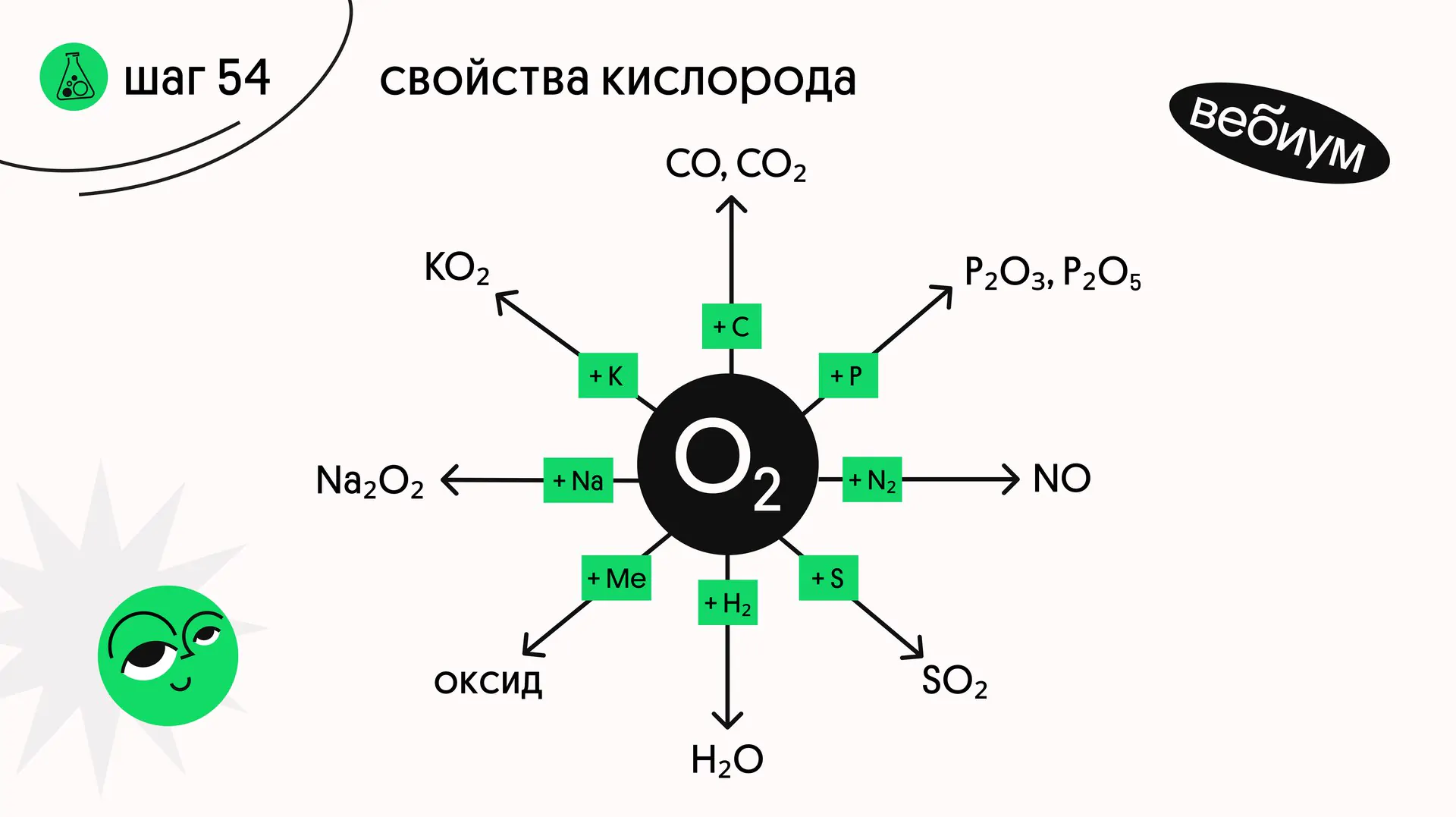
Кислород — сильный окислитель. Из простых веществ он не окисляет только инертные газы, благородные металлы (Ag, Au, Pt) и галогены.
1️⃣ + металлы
2Cu + O₂ → 2CuO (t°C)
4Li + O₂ → 2Li₂O (оксид лития)
2Na + O₂ → Na₂O₂ (пероксид натрия)
Ba + O₂ → BaO₂ (t°C) (пероксид бария)
K + O₂ → KO₂ (надпероксид калия
2️⃣ + неметаллы
O₂ + 2F₂ → 2OF₂ (электрический разряд)
S + O₂ → SO₂ (t°C)
N₂ + O₂ ⇄ 2NO — Q (t°C)
4P + 3O₂ → 2P₂O₃ (t°C)
C + O₂ → CO₂ (t°C)
Si + O₂ → SiO₂ (t°C)
O₂ + 2H₂ → 2H₂O (t°C)
Кислород не реагирует с хлором, бромом и иодом ❌
3️⃣ + оксиды
Оксиды, в которых элемент находится не в высшей степени окисления, могут окисляться кислородом. Стоит запомнить оксиды, которые встретятся на экзамене:
SO₂ (в присутствии V₂O₅), P₂O₃, CO, NO, SiO, FeO, Fe₃O₄, Cu₂O, MnO, CrO.
4️⃣ + некоторые бинарные вещества
2CuS + 3O₂ → 2CuO + 2SO₂ (t°C)
4NH₃ + 3O₂ → 2N₂ + 6H₂O (t°C) — горение аммиака
4NH₃ + 5O₂ → 4NO + 6H₂O (кат, t°C) — каталитическое окисление аммиака
5️⃣ + органические вещества
СH₄ + 2O₂ → CO₂ + 2H₂O (t°C)
2CH₃Cl + 3O₂ → 2CO₂ + 2H₂O + 2HCl (t°C)
4CH₃NH₂ + 7O₂ → 2CO₂ + 10H₂O + 2N₂ (t°C)
Авторизуйтесь, чтобы оставить комментарий.