Азот — элемент VA группы, командир и глава пниктогенов. У азота 5 валентных электронов, два из них спарены. Максимальная валентность азота в соединениях — IV!
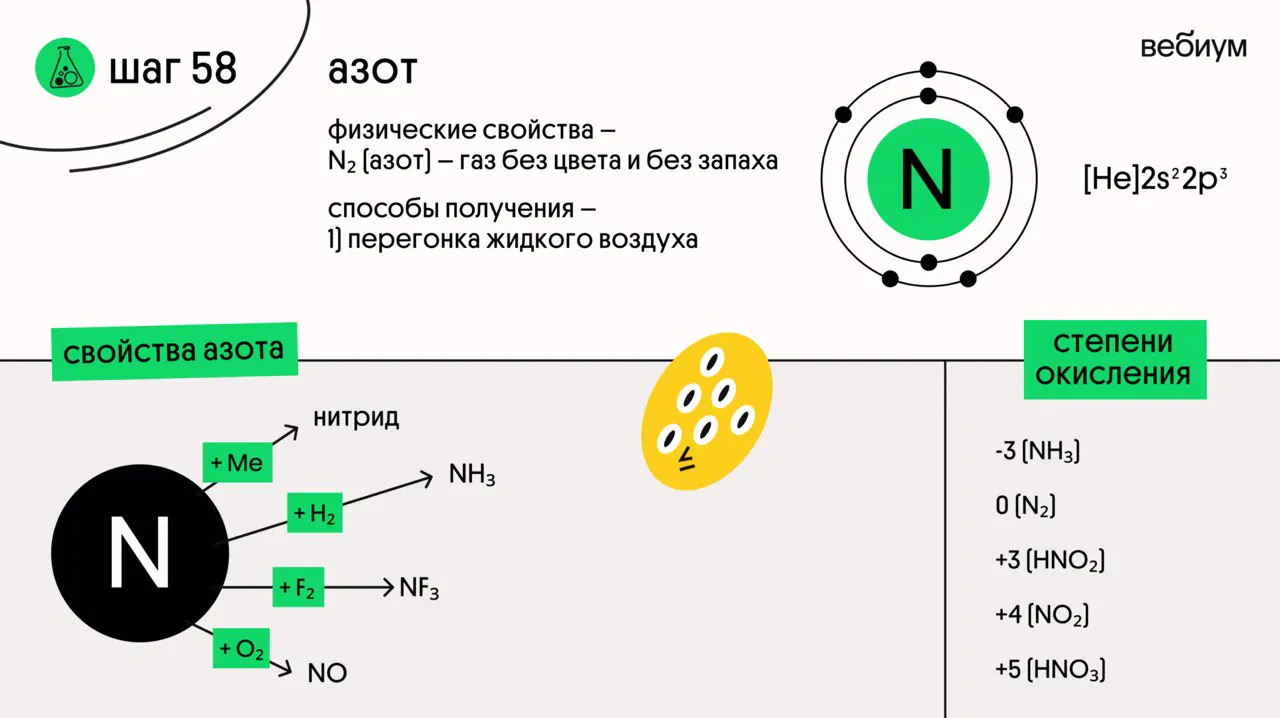 Азот может иметь любую степень окисления от -3 до +5.
Азот может иметь любую степень окисления от -3 до +5.
Азот при обычных условиях — газ без цвета и запаха, состоит из молекул N₂.
Азот — основной компонент воздуха (около 78% по объему) и именно из воздуха азот и получают.
Если очень захочется получить азот в лаборатории, ну или нужно записать реакцию с получением азота, то держи парочку:
(NH₄)₂Cr₂O₇ → Cr₂O₃ + N₂ + 4H₂O (t°C)
NH₄NO₂ → N₂ + 2H₂O (t°C)
Между атомами в N₂ образуются 3 ковалентные связи, поэтому энергия диссоциации молекулы высока. Азот реагирует с ограниченным количеством веществ и при нагревании
1️⃣ + металлы (активные и средней активности)
6Na + N₂ → 2Na₃N (t°C)
6Li + N₂ → 2Li₃N (с литием реакция протекает без нагревания!)
2️⃣ + неметаллы
N₂ + O₂ ⇄ 2NO (t°C)
N₂ + 3F₂ → 2NF₃ (эл. разряд)
N₂ + 3H₂ ⇄ 2NH₃ (t, p, кат)
С остальными неметаллами азот не реагирует.
АММИАК (NH₃)
В обычных условиях это бесцветный газ с резким запахом (нашатырный спирт — раствор аммиака), очень хорошо растворим в воде💧
В промышленности аммиак получают из простых веществ. Реакция протекает при температуре 500°C, давлении 350 атм и в присутствии катализатора (пористое железо). Такой способ получения аммиака получил название «процесс Габера «»
Реакция обратима, выход аммиака составляет около 30% 👩🔬
N₂ + 3H₂ ⇄ 2NH₃ (t, p, кат).
В лаборатории аммиак можно получить действием щелочей на соли аммония:
NH₄Cl + NaOH → NaCl + NH₃ + H₂O
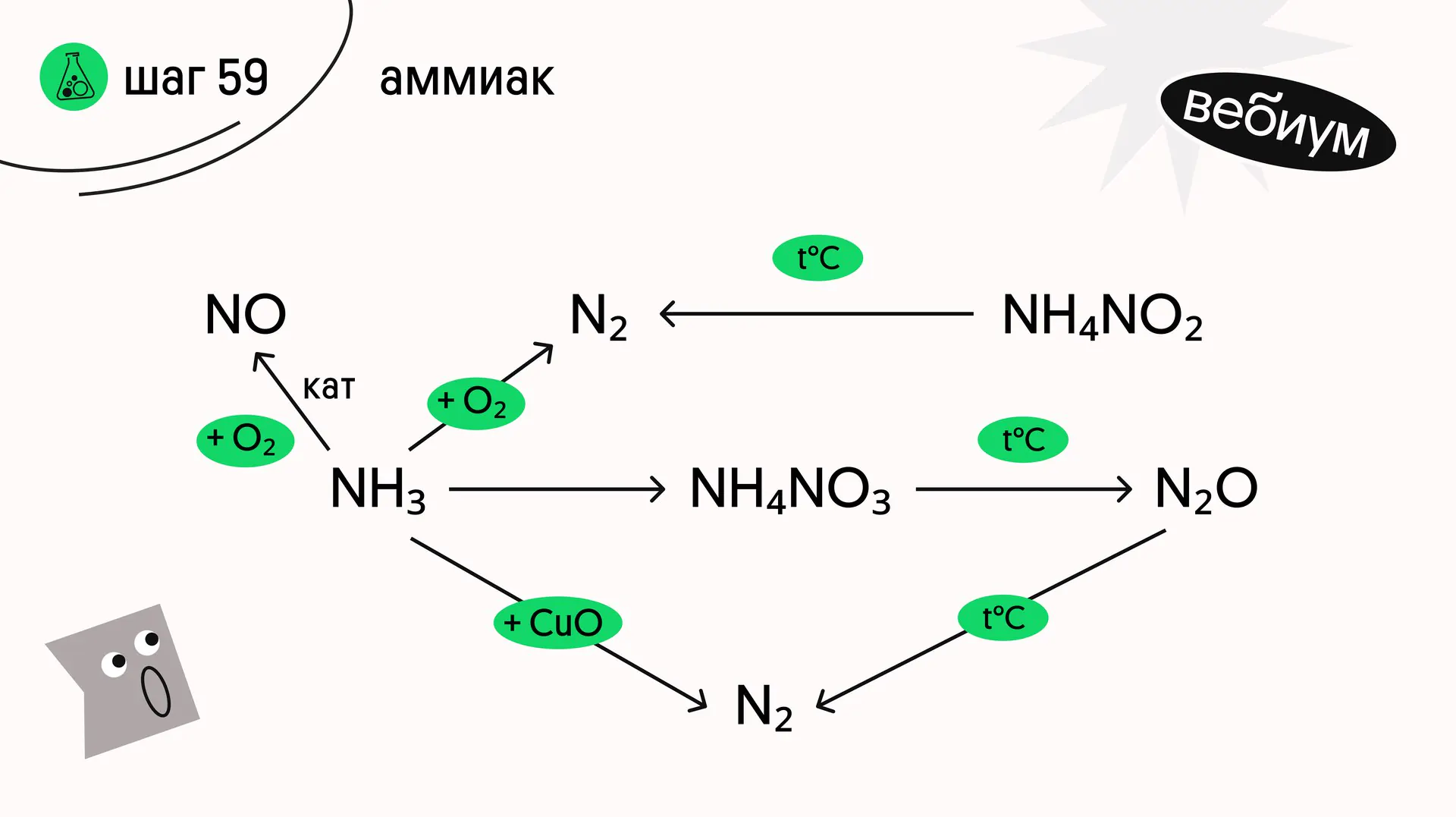
Аммиак проявляет только восстановительные свойства. Обратите внимание на две реакции аммиака и кислорода:
4NH₃ + 3O₂ → 2N₂ + 6H₂O (t°C) — горение аммиака.
4NH₃ + 5O₂ → 4NO + 6H₂O (кат, t°C) — каталитическое окисление аммиака.
При нагревании аммиака с оксидами некоторых тяжелых металлов и галогенов образуется молекулярный азот:
3СuO + 2NH₃ → 3Cu + N₂ + 3H₂O (t°C)
2NH₃ + Br₂ → N₂ + 6HBr (t°C)
При растворении аммиака в воде образуется раствор с щелочной средой, окрашивающий лакмус в синий цвет
Такое основание вступает в реакции обмена с кислотами, растворимыми солями:
2NH₃ + H₂SO₄ → (NH₄)₂SO₄
3NH₃ + 3H₂O + AlCl₃ → Al(OH)₃ + 3NH₄Cl
Все соли аммония хорошо растворимы в воде, при нагревании разлагаются:
NH₄Cl → NH₃ + HCl (t°C)
NH₄NO₃ → N₂O + 2H₂O (t°C)
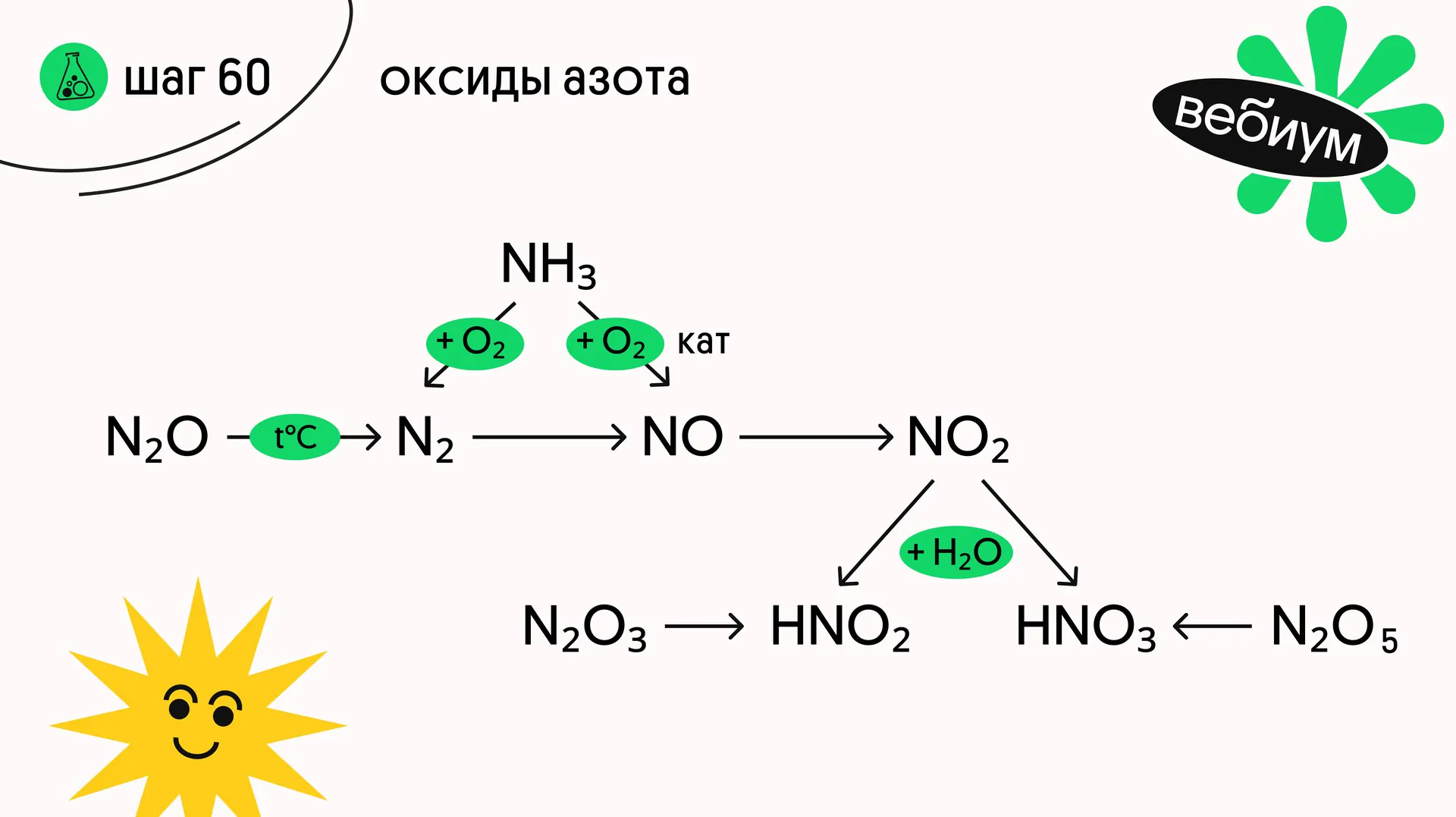
Нам в ЕГЭ могут встретится и несолеобразующие оксиды (NO, N₂O), и солеобразующие (N₂O₃, NO₂, N₂O₅)
ℹ️ ОКСИД АЗОТА(I)
N₂O — бесцветный газ со слабым запахом, хорошо растворим в воде, при нагревании разлагается на простые вещества:
2N₂O → 2N₂ + O₂ (t°C)
В медицине применяется для наркоза, его также называют «веселящим» газом
ℹ️ОКСИД АЗОТА(II)
NO — газ без цвета и запаха, малорастворим в воде. Образуется из простых веществ при электрическом разряде или очень высокой температуре:
N₂ + O₂ ⇄ 2NO (t°C)
В промышленности оксид азота(II) получают каталитическим окислением аммиака:
4NH₃ + 5O₂ → 4NO + 6H₂O (кат, t°C)
В лаборатории его можно получить при взаимодействии меди и разбавленной азотной кислоты:
3Cu + 8HNO₃ → 3Cu(NO₃)₂ + 2NO + 4H₂O
NO легко окисляется кислородом, быстро буреет на воздухе:
2NO + O₂ → 2NO₂
ℹ️ОКСИД АЗОТА(III)
N₂O₃ — нестабильная жидкость синего цвета. При растворении в воде образует азотистую кислоту:
N₂O₃ + H₂O → 2HNO₂
ℹ️ОКСИД АЗОТА(IV)
NO₂ — бурый газ с резким запахом, ядовит.
Хорошо растворяется в воде с образованием смеси кислот:
2NO₂ + H₂O → HNO₂ + HNO₃
(аналогично реакции протекают с щелочами — с образованием нитрита и нитрата)
В присутствии кислорода образуется только азотная кислота:
4NO₂ + 2H₂O + O₂ → 4HNO₃
В промышленности NO₂ получают окислением NO:
2NO + O₂ → 2NO₂
В лаборатории — действием концентрированной азотной кислоты на медь:
Cu + 4HNO₃ → Cu(NO₃)₂ + 2NO₂ + 2H₂O
ℹ️ОКСИД АЗОТА(V)
N₂O₅ — бесцветные кристаллы, хорошо растворимы в воде с образованием азотной кислоты:
N₂O₅ + H₂O → 2HNO₃
Авторизуйтесь, чтобы оставить комментарий.