🔹 ОБЩИЕ СВЕДЕНИЯ
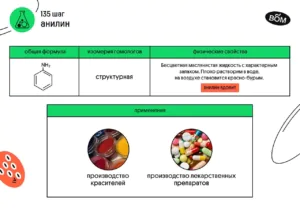
Анилин (С₆H₅NH₂), он же фениламин — ароматический амин.
🔹 ФИЗИЧЕСКИЕ СВОЙСТВА
Это бесцветная маслянистая жидкость с характерным запахом. Он плохо растворим в воде, на воздухе становится красно-бурым.
Анилин ядовит ⚠️
🔹 СПОСОБЫ ПОЛУЧЕНИЯ
1️⃣ Восстановление нитробензола водородом
Условие: t°C, p, кат.
С₆H₅NO₂ + 3H₂ → С₆H₅NH₂ + 2H₂O (t°C, p, кат.)
2️⃣ Восстановление нитробензола сульфидом аммония (реакция Зинина)
С₆H₅NO₂ + 3(NH₄)₂S → С₆H₅NH₂ +3S + 6NH₃ + 2H₂O
🔹 ХИМИЧЕСКИЕ СВОЙСТВА
Анилин — более слабое основание, чем аммиак!
Для анилина характерны реакции как по аминогруппе, так и по кольцу
1️⃣ Взаимодействие с минеральными кислотами
С₆H₅NH₂ + HCl → [С₆H₅NH₃]Cl (хлорид фениламмония)
2️⃣ Взаимодействие с галогеналканами
Условие: t°C
С₆H₅NH₂ + СH₃Cl → [С₆H₅NHСH₃]Cl (t°C)
3️⃣ Взаимодействие с HNO₂
Условие: t°C
С₆H₅NH₂ + HNO₂ → С₆H₅OH + N₂ + H₂O (t°C)
Для реакции обычно используют смесь нитрита и соляной/серной кислоты:
С₆H₅NH₂ + KNO₂ + HCl → С₆H₅OH + N₂ + H₂O + KCl
✍️ Посмотри в учебнике, как на самом деле идёт эта реакция. Правда «ЕГЭшные амины» не такие уж и страшные?
4️⃣ Взаимодействие с бромной водой — качественная реакция на анилин!
С₆H₅NH₂ + 3Br₂ → 2,4,6-триброманилин + 3HBr
Происходит обесцвечивание раствора и образование осадка белого цвета.
❗️Аминогруппа — ориентант первого рода, она ориентирует в орто- и пара- положения.
5️⃣ Горение
Условие: t°C
4С₆H₅NH₂ + 31O₂ → 24CO₂ + 2N₂ + 14H₂O (t°C)
🔹 ПРИМЕНЕНИЕ АНИЛИНА
Анилин используется в производстве красителей и лекарственных препаратов.
Авторизуйтесь, чтобы оставить комментарий.