✍️ Смесь магниевых и алюминиевых опилок обработали избытком разбавленной соляной кислоты, при этом выделилось 22,4 л (н.у.) водорода. Если такую же массу смеси обработать избытком раствора гидроксида калия, то выделится 13,44 л (н.у.) водорода. Рассчитайте массовую долю магния в исходной смеси.
💯 Решение (с комментариями):
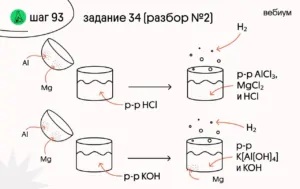
1️⃣ Запишем уравнения реакций:
(1) Mg + 2HCl → MgCl₂ + H₂
(2) 2Al + 6HCl → 2AlCl₃ + 3H₂
(3) Mg + KOH →
(4) 2Al + 2KOH + 6H₂O → 2K[Al(OH)₄] + 3H₂
2️⃣ Вычислим количество водорода, который выделился в 4-й реакции:
n(H₂) = Vн.у.(H₂) / Vm = 13,44 л / 22,4 л/моль = 0,6 моль
Этот водород выделился при действии на смесь раствора гидроксида калия. С гидроксидом реагирует только алюминий, значит, весь водород (0,6 моль) приходится на (4) реакцию.
По уравнению (4):
n(Al)/2 = n(H₂)/3
n(Al) = 0,4 моль
Значит, в смеси содержится 0,4 моль алюминия!
3️⃣ Разберёмся с водородом в реакциях (1) и (2):
n(H₂) = Vн.у.(H₂) / Vm = 22,4 л / 22,4 л/моль = 1 моль
Это суммарное количество водорода, которое выделяется в реакциях (1) и (2), так как с кислотой реагируют оба металла!
Вычислим сколько водорода выделится в реакции (2), мы же знаем количество алюминия!
По уравнению (2):
n(Al)/2 = n(H₂)/3
n(H₂) = 0,6 моль
То есть всего выделилось 1 моль водорода, а во второй реакции только 0,6 моль. Значит остальные 1 моль — 0,6 моль = 0,4 моль водорода выделились в первой реакции!
По уравнению (1):
n(Mg)/1 = n(H₂)/1
n(Mg) = 0,4 моль
4️⃣ Вычислим массу каждого металла в смеси:
m(Al) = n(Al)⋅M(Al) = 0,4 моль ⋅ 27 г/моль = 10,8 г
m(Mg) = n(Mg)⋅M(Mg) = 0,4 моль ⋅ 24 г/моль = 9,6 г
5️⃣ Общая масса смеси:
m(смеси) = m(Al) + m(Mg) = 10,8 г + 9,6 г = 20,4 г
6️⃣ Массовая доля магния в исходной смеси:
w(Mg) = m(Mg)/m(смеси) ⋅ 100% = 9,6 г ⋅ 100% / 20,4 г = 47,1%
Авторизуйтесь, чтобы оставить комментарий.