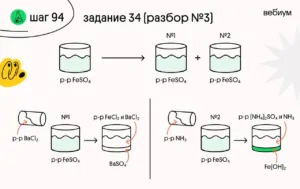
✍️ Растворимость безводного сульфата железа(II) при некоторой температуре составляет 30,4 г на 100 г воды. При этой температуре приготовили 326 г насыщенного раствора сульфата железа(II). Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида бария. При этом образовалось 46,6 г осадка. К раствору во второй колбе добавили 50 г 34%-го раствора аммиака. Определите массовую долю аммиака в конечном растворе во второй колбе.
💯 Решение (с комментариями):
1️⃣ Запишем уравнения реакций:
(1) FeSO₄ + BaCl₂ → BaSO₄ + FeCl₂
(2) FeSO₄ + 2NH₃∙H₂O → Fe(OH)₂ + (NH₄)₂SO₄
2️⃣ Если в 100 г воды может раствориться 30,4 г соли (масса раствора при этом равна 130,4 г), то в 326 г раствора может раствориться:
m(FeSO₄) = 30,4 ∙ 326 / 130,4 = 76 г
n(FeSO₄) = m(FeSO₄) / M(FeSO₄) = 76 г / 152 г/моль = 0,5 моль
3️⃣ Разберёмся с первой колбой (с первым уравнением).
n(BaSO₄) = m(BaSO₄) / M(BaSO₄) = 46,6 г / 233 г/моль = 0,2 моль
По уравнению (1):
n(FeSO₄)/1 = n(BaSO₄)/1
n(FeSO₄) = n(BaSO₄) = 0,2 моль
Значит, в первой колбе было 40% (100% ∙ 0,2/0,5) исходного насыщенного раствора сульфата железа(II).
4️⃣ Во второй колбе 60% раствора массой 326∙60%/100% = 195,6 г
n(FeSO₄) = 0,5 моль — 0,2 моль = 0,3 моль
m(NH₃) = m(р-ра) ∙ w(NH₃) / 100% = 50 г ∙ 34% / 100% = 17 г
n(NH₃) = m(NH₃) / M(NH₃) = 17 г / 17 г/моль = 1 моль — это исходное количество аммиака.
По уравнению (2):
n(FeSO₄)/1 = n(NH₃)/2
n(NH₃) = 2 ∙ n(FeSO₄) = 2 ∙ 0,3 моль = 0,6 моль
В растворе осталось аммиака:
n(NH₃) = 1 моль — 0,6 моль = 0,4 моль
m(NH₃) = n(NH₃)⋅M(NH₃) = 0,4 моль ⋅ 17 г/моль = 6,8 г
5️⃣ Масса конечного раствора во второй колбе:
m(р-ра) = m(р-ра FeSO₄) + m(р-ра NH₃) — m(Fe(OH)₂)
По уравнению (2):
n(FeSO₄)/1 = n(Fe(OH)₂)/1
n(Fe(OH)₂) = n(FeSO₄) = 0,3 моль
m(Fe(OH)₂) = n(Fe(OH)₂)⋅M(Fe(OH)₂) = 0,3 моль ⋅ 90 г/моль = 27 г
m(р-ра) = 195,6 г + 50 г — 27 г = 218,6 г
6️⃣ Находим массовую долю аммиака во второй колбе:
w(NH₃) = m(NH₃) ⋅100% / m(р-ра) = 6,8 г ⋅ 100% / 218,6 г = 3,11%
Авторизуйтесь, чтобы оставить комментарий.